Список сокращений:
ИК – искусственное кровообращение
АИК – аппарат искусственного кровообращения
ОПК – отделение переливания крови
КЕК – кислородная емкость крови
ЦВК – центральный венозный катетер
ЭКС - электрокардиостимуляция
Предпосылки
Начиная с 90-х годов предыдущего столетия начала активно изменяться тактика трансфузионной терапии при кардиохирургических операциях с использованием ИК (1). Склонность к значительным кровопотерям при операциях с ИК, обусловленнная вмешательством на большом количестве сосудистых структур с одной стороны и повреждением системы гемостаза при использовании ИК с другой, приводила к необходимости применения большого количества компонентов крови. С ростом числа кардиохирургических операций, и соответственно, объема переливаемых компонентов крови увеличивалось и количество осложнений обусловленных трансфузией чужеродной крови (см. табл. 1). Эти осложнения послужили поводом для разработки альтернативных методов, позволяющих сократить или вовсе отказаться от переливания донорской крови (3-7).
Таблица 1. Неблагоприятные последствия и ограничения, связанные с использованием гомологичной крови
1. Инфекционные заболевания, передающиеся с кровью
- вирус иммунодефицита человека
- вирусы гепатита
- цитомегаловирус
- сифилис
- малярия
- токсоплазмоз
- возможна бактериальная контаминация и др.
2.
Реакции несовместимости
- по группе крови
- по резус-фактору
- реакция «трансплантат против хозяина»
3.
Температурная реакция
4.
Недостаточное содержание в гомологичной крови
-
2,3-дифосфоглицерата
- тромбоцитов
- снижение факторов V и VIII на 10-20% в течение 24 часов
5.
Ограниченное количество компонентов крови в ОПК.
6. Сравнительно высокая стоимость компонентов крови. |
| |
Одним из таких методов является резервирование крови перед началом ИК с ее реинфузией после окончания искусственного кровообращения.
Впервые методика предоперационной заготовки аутокрови с последующей ее реинфузией была успешно применена в 1921 году (8), но в связи с успехами разработки консервантов для заготовки гомологичной крови ее рутинное использование не прижилось. В связи с развитием сердечно-сосудистой хирургии и сопутствующим значимым увеличением потребности в препаратах крови, интерес к заготовке аутокрови увеличился. Использование 8-12 доз крови при операции с ИК было не редкостью (9, 10). В начале 70-х годов прошлого столетия в связи с развитием коронарной хирургии в США сложилась ситуация, при которой весь национальный запас крови мог быть израсходован только на кардиохирургию (11). Кроме того, осложнения и риски связанные с трансфузией гомологичной крови, приводили к дальнейшему поиску методов её сбережения (11,12,13). Понимание того факта, что лучшим донором для трансфузии крови является сам пациент, привело к развитию методик по заготовке и последующей реинфузии аутокрови (14,15). Одна из них - методика интраоперационного резервирования крови. Преимуществами последней являются не только снижение рисков, связанных с переливанием гомологичной крови, но и обеспечение пациента свежей кровью более богатой 2,3 – дифосфоглицератом, тромбоцитами и факторами свертывания, чем заранее заготовленные компоненты крови из отделения переливания крови (16).
Общие физиологические принципы
Интраоперационная заготовка крови при операциях на сердце осуществляется перед началом ИК, либо сразу же после начала ИК. Основной целью забора является исключение повреждающего воздействия контура и аппарата ИК на кровь пациента. Изъятый объем крови, как правило, замещается вводимыми внутривенно или в аппарат ИК изотоническими растворами (коллоиды, кристаллоиды). Если для поддержания гемодинамики или объемной скорости перфузии не требуется введения равноценного по объему количества замещающих растворов, их объем желательно сократить до минимально необходимого. Особенности проведения операций на сердце (большая водная нагрузка, возможность регулировать минутный объем кровообращения и температуру тела во время ИК для компенсирования относительной анемии) требуют и позволяют это осуществлять, т.е. сокращать водную нагрузку до минимально необходимой. Реинфузия крови осуществляется после окончания ИК. Большинство кардиохирургических пациентов являются кандидатами для интраоперационной заготовки аутокрови если они соответствуют двум важным критериям. Во-первых, пациенты должны быть гемодинамически стабильны, а во-вторых, они должны иметь достаточное количество эритроцитов, чтобы поддерживать адекватную кислородную емкость крови (КЕК) с учетом последующей гемодилюции. Несмотря на то, что минимально приемлемый уровень гематокрита во время ИК остается предметом дискуссий, для большинства пациентов гематокрит 20% является безопасным (10,11,17-19). Снижение уровня гемоглобина компенсируется снижением вязкости крови, что в свою очередь приводит к снижению работы сердца и улучшению коронарной микроциркуляции (19-23).
Для обеспечения адекватного уровня гемоглобина во время ИК, важно оценить какой уровень гемоглобина будет у пациента после резервирования аутокрови, а также вследствие разведения объемом первичного заполнения АИК. Гемоглобин после интраоперационного резервирования крови может быть рассчитан следующим образом:
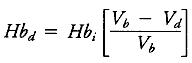
где Hbd – гемоглобин после резервирования аутокрови, Hbi – гемоглобин перед резервированием, Vb – общий объем крови, Vd – объем резервированной крови. Приблизительно объем крови пациента в литрах равен 6%-8% от массы тела пациента в килограммах и зависит эта величина от возраста, пола и клинического состояния пациента (24-26).
Гемоглобин пациента во время ИК (Hbb) после дальнейшего разведения за счет объема первичного заполнения АИК, может быть вычислен следующим образом:
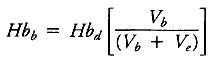
где Hbd – гемоглобин после резервирования аутокрови, Vb – общий объем крови, Ve – первичный объем заполнения АИК.
Соответственно, максимальный объем крови, который может быть резервирован (Vd,max), для поддержания гемоглобина во время ИК выше определенного минимального уровня (Hbe,min) может быть рассчитан следующим образом:
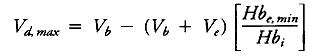
где Ve – объем заполнения АИК, Vb – предполагаемый объем крови пациента, Hbi – исходный уровень гемоглобина.
В большинстве случаев, безопасным для пациентов является резервирование как минимум 10% объема крови пациента до начала ИК (11,27-29).
Показания
В большинстве проведённых исследований было продемонстрировано, что интраоперационная заготовка крови с последующей ее реинфузией снижает общую потребность в гомологичной крови, по крайней мере на 20-50% (10,17,27,28,30-39). Кроме этого, снижается потребность в свежезамороженной плазме, которая используется для контроля послеоперационной коагулопатии (33-35,39). Реинфузия аутокрови, заготовленной до воздействия на нее повреждающих эффектов ИК, имеет несколько преимуществ в отношении гемостаза. В нескольких исследованиях было продемонстрировано увеличение общего количества тромбоцитов (30,31,40), а также сохранение их качественных свойств (41) по сравнению с пациентами, не подвергавшимися резервированию и последующей реинфузии аутокрови. Кроме того, у пациентов, получающих реинфузию предварительно заготовленной крови, менее выражен дефицит факторов коагуляции в послеоперационном периоде (31). Соответственно, улучшение коагуляционного статуса приводит к уменьшению объема кровопотери в послеоперационном периоде.
Безопасность интраоперационного резервирования аутокрови демонстрировалась неоднократно (11,27,28,29,31,36,37,42). Несмотря на то, что может возникать транзиторная умеренная гипотензия (28,29), не было выявлено серьезных осложнений, если процедура выполнялась правильно. Использование интраоперационной заготовки крови перед началом ИК может быть показано для всех пациентов, у которых уровень предоперационного гемоглобина позволяет перенести необходимую гемодилюцию, связанную с использованием этой методики.
Интраоперационное резервирование является привлекательной методикой сохранения крови для большинства пациентов, подвергающихся кардиохирургической операции. Это недорогой, простой метод заготовки свежей крови, исключающий передачу трансмиссивных заболеваний, аллергические реакции и не зависящий от наличия крови в ОПК (2).
Интраоперационно заготовленная кровь является идеальным продуктом для инфузии после ИК, так как она не только содержит эритроциты, но также и свежие факторы коагуляции, тромбоциты и другие важные плазменные компоненты (например, IL-10, противовоспалительный фактор). Учитывая, что результаты исследований, а также опыт нашей работы, показывают высокую эффективность при минимальном риске процедуры, мы рекомендуем интраоперационный забор аутокрови и последующую реинфузию планировать у всех пациентов, подвергающихся операциям с ИК.
Методика резервирования аутокрови
Целью интраоперационной заготовки аутокрови является резервирование максимально возможного количества крови для исключения неблагоприятных воздействий ИК с ее реинфузией после окончания ИК. Основными условиями при этом являются обеспечение стабильности гемодинамики и поддержание приемлемого уровня гемоглобина. Важным условием осуществления безопасного интраоперационного резервирования аутокрови у кардиохирургических пациентов является осуществление инвазивного гемодинамического и электрокардиографического мониторинга. Для сохранения стабильной гемодинамики необходимо поддержание соответствия внутрисосудистого объема циркулирующей крови, емкости сосудистого русла в конкретный момент времени путем внутривенного введения разумных объемов коллоидных или кристаллоидных растворов, а также дозированного введения вазоактивных препаратов, если это необходимо. Кислородная емкость крови должна поддерживаться на удовлетворительном уровне для предотвращения гипоксии тканей критических органов. Для этой цели мы стараемся возмещать объем минимально необходимым количеством жидкости, что приводит к незначительному снижению концентрации гемоглобина после забора крови на этапе до начала ИК. Большая стабильность гемодинамики отмечается, если момент начала эксфузии крови совпадает по времени с этапом наибольшей хирургической стимуляции – у кардиохирургических пациентов это этап стернотомии.
Для интраоперационной заготовки крови может использоваться несколько различных методик. В любом случае кровь резервируется до или сразу же после начала ИК. Это исключает или минимизирует контакт крови и компонентов крови с поверхностью контура АИК. Наиболее часто забор крови осуществляют через центральный венозный катетер (в нашей клинике с этой целью используется интродьюсер), артериальный катетер или магистраль венозного оттока АИК (31). Какая бы методика не использовалась, важнейшей задачей остается поддержание стабильной гемодинамики во время резервирования крови.
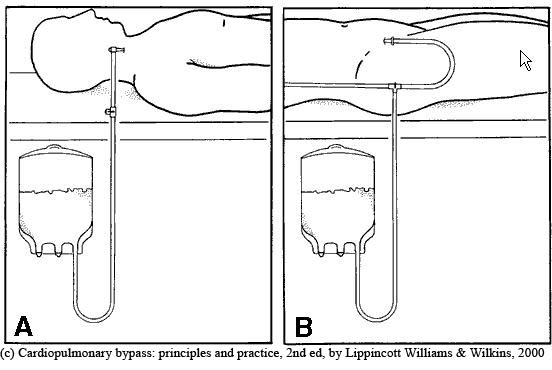
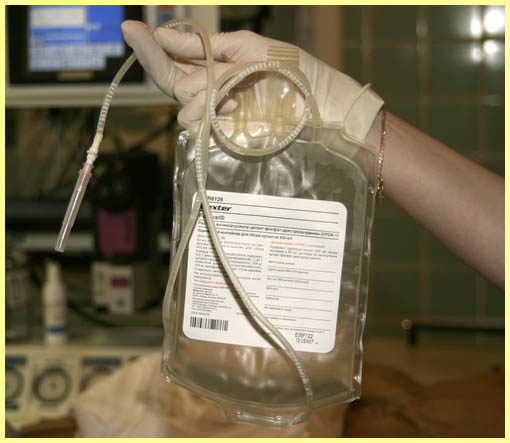
Если кровь забирается из ЦВК или интродьюсера, через краник подсоединяется короткая стерильная магистраль, ведущая к пакету для заготовки крови, который содержит антикоагулянт. В своей практике мы предпочитаем использовать интродьюсер калибра 8Fr, установленный во внутренней яремной вене. Помимо эксфузии крови он может использоваться для быстрой инфузии любых жидкостей и введения препаратов, установки катетера Сван-Ганца или электрода для эндокардиальной ЭКС. Пакет для заготовки крови устанавливается ниже уровня правого предсердия пациента, и кровь поступает в него под действием силы тяжести (рис.А). Процедура начинается после индукции анестезии (мы стараемся проводить ее в момент стернотомии) и завершается до введения гепарина.
Одновременно, для поддержания стабильности гемодинамики, эксфузированный объем крови замещается кристалоидными иликоллоидными растворами, поступающими внутривенно через периферический катетер. Эта методика является привлекательной по нескольким причинам: она не требует сложного оборудования и дополнительной подготовки, забор крови осуществляется постепенно и может быть легко компенсирован внутривенным введением жидкости; небольшое количество антикоагулянта в пакете оказывает минимальное воздействие на коагуляцию после реинфузии крови. Главным ограничением использования этой методики является то, что выполнение ее занимает достаточно длительное время (при использовании интродьюсера этой проблемы не существует), а при некоторых кардиохирургических вмешательствах время от начала анестезии до начала ИК может быть относительно коротким. Кроме того, медленное поступление крови в пакет с антикоагулянтом сопровождается активацией процессов коагуляции за счет контакта с системой для забора, что приводит к достоверно большему содержанию сгустков и агрегатов форменных элементов в пакете, хотя в своей практике мы этого не ощущали. Более существенным, с нашей точки зрения, является то, что внимание анестезиолога может быть отвлечено от пациента во время осуществления забора крови, что может быть причиной развития неблагоприятных последствий.
Другим способом резервирования крови является забор крови через артериальный катетер (рис. В).
Преимуществом этого метода является то, что забор может быть осуществлен достаточно быстро. Недостатком этого метода является повышенный риск транзиторной гиповолемии и гипотензии во время резервирования крови, а также трудности с мониторингом артериального давления, если установлен только один артериальный катетер.
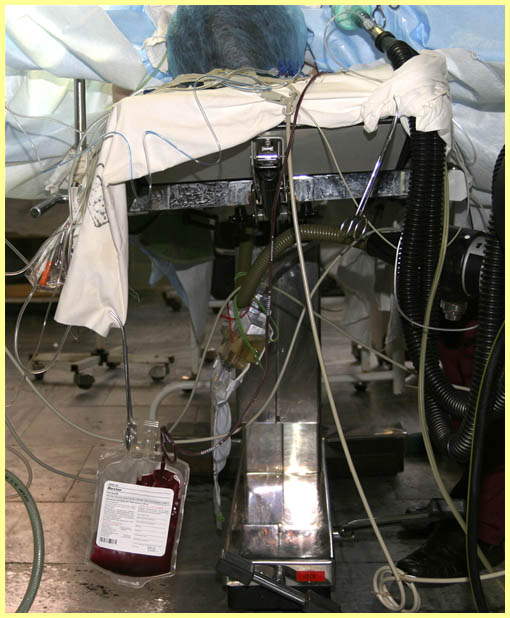
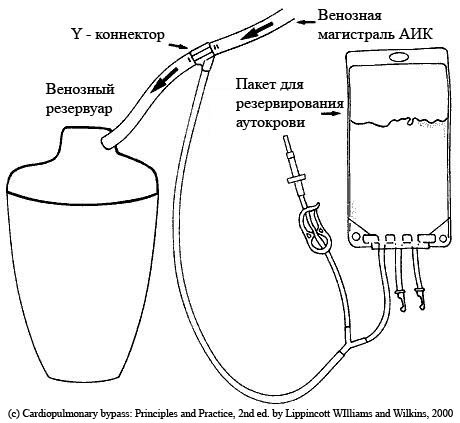 В качестве альтернативы, кровь можно забирать в самом начале ИК через Y-коннектор установленный в венозную магистраль контура АИК (рис. слева). В качестве альтернативы, кровь можно забирать в самом начале ИК через Y-коннектор установленный в венозную магистраль контура АИК (рис. слева).
Этот коннектор позволяет крови проходить беспрепятственно либо в венозный резервуар, либо дренироваться в пакет для сохранения крови. Непосредственно перед началом ИК сегмент Y-коннектора ведущий к пакету для заготовки крови перекрывается до тех пор, пока венозная кровь не начнет поступать в резервуар. Как только это произойдет, венозный возврат, поступающий в резервуар, перекрывается и кровь начинает дренироваться в мешок для заготовки крови. Одновременно, объем первичного заполнения начинает вводиться через аортальную канюлю, восполняя потерю объема. После изъятия необходимого количества крови, дренажная трубка, ведущая к пакету для заготовки крови, пережимается, и венозный возврат направляется в резервуар. При использовании этой методики необходимости в добавлении в пакет антикоагулянта нет, т. к. пациентполностью гепаринизирован. Забранная кровь маркируется и может быть реинфузирована в экстракорпоральный контур перфузиологом, если гемоглобин во время ИК станет недопустимо низким. Кровь реинфузируется пациенту в конце ИК или после его завершения до введения протамина или параллельно с его введением.
Проведение забора непосредственно перед началом ИК через венозную магистраль является привлекательным из-за возможности быстро резервировать большой объем крови. Также эту процедуру относительно просто выполнить, так как не требуется большой подготовки. Гиповолемия может быть быстро корригирована введением дополнительного объема из АИК через установленную аортальную канюлю. Общая гемодилюция существенно меньше, чем при заборе крови после индукции анестезии Недостатком этой методики является присутствие гепарина в резервированной крови, что требует нейтрализации протамином после реинфузии. Следует отметить, что тромбоциты и факторы коагуляции хорошо сохраняются при использовании этой методики (31).
Любопытная ссылка по теме:
Multidisciplinary management of a Jehovah's Witness patient for the removal of a renal carcinoma extending into the right atrium
Литература:
-
А.А. Бунятян, Н.А. Трекова, А.В. Мещеряков и др. Руководство по кардиоанестезиологии. МИА, 2005.
-
Clenn P. Gravlee, Richard F. Davis, Mark Kurusz, Joe R. Utley. Cardiopulmonary bypass: principles and practice, Chapter 7. Hemofiltration, Dialysis and Blood Salvage Techniques. 2nd ed. Lippincott Williams&Wilkins 2000.
-
Milam JD. Blood transfusion in heart surgery. Clin Lab Med 1982;1:65-85.
-
Cosgrove DM, Loop FD, Lytle BW, et. al. Determinants of blood utilization during myocardial revascularization. Ann Thorac Surg 1985;40:380-384
-
Campbell FW, Addonizio VP Jr. Platelet function alterations during heart surgery. In: Ellison N, Jobes DR, eds. Effective hemostasis in cardiac surgery. Philadelphia: W.B.Saunders, 1988:85-109.
-
Edmunds LH, Addonizio VP Jr. Platelet physiology during cardiopulmonary bypass. In: Utley Jr, ed. Pathophysiology and techniques of cardiopulmonary bypass. Baltimore: Williams & Wilkins, 1982:106-119.
-
Gravlee GP, Hopkins MB. Blood plasma products. In: Ellison N, Jobes DR, eds. Effective hemostasis in cardiac surgery. Philadelphia: W.B.Saunders, 1988:69-83.
-
Grant FC. Autotransfusion. Ann Surg 1921;74:253-254.
-
Roche JK, Stengle JM. Open-heart surgery and the demand for blood. JAMA 1973;225:1516-1521.
-
Cohn LH, Fosberg AM, Anderson RP, et al. The effects of flebotomy, hemodilution and autologous transfusion on systemic oxygenation and whole blood utilization in open heart surgery. Chest 1975;68:283-287.
-
Tector AJ, Gabriel RP, Mateicka WE, et. al. Reduction of blood usage in open heart surgery. Chest 1976;4:454-457.
-
Utley JR, Moores WY, Stephens DB. Blood conservation techniques. Ann Thorac Surg 1981;31:482-490.
-
Brzica SM, Pineda AA, Taswell HF. Autologous blood transfusion. Mayo Clin Proc 1976;51:723-737
-
Council on Scientific Affairs. Autologous blood transfusions. JAMA 1986;256:2378-2380.
-
Yomtovian RA, Autologous blood transfusion: past performance and current concerns. Minn Med 1986;69:353-356.
-
Kramer AH, Hertzer NR, Beven KG. Intraoperative hemodilution during elective vascular reconstruction. Surg Gynecol Obstet 1979;149:831-836.
-
Lawson NW, Ochsner JL, Mills NL, et al. The use of hemodilution and fresh autologous blood in open-heart surgery. Anesth Analg 1974;53:672-683.
-
Buckley MJ, Austen WG, Goldblatt A, et al. Severe hemodilution and autotransfusion for surgery of congenital heart disease. Surg Forum 1971;22:160-162
-
Seager OA, Nesmith MA, Begelman KA, et al. Massive acute hemodilution for incompatible blood reaction. JAMA 1974;229:790-792.
-
Nahas RA, Mundth ED, Buckley MJ, et al. Effect of hemodilution on left ventricular function with regional ischemia of the heart. Surg Forum 1972;23:149-150.
-
Yoshikawa H, Powell WJ, Bland JHL, et al. Effect of acute anemia on experimental myocardial ischemia. Am J Cardiol 1973;32:670-678.
-
Pavek K, Carey JS. Hemodynamics and oxygen availability during isovolemic hemodilution. Am J Physiol 1974;226:1172-1177.
-
Messmer K, Sunder-Plasmann L, Jesch L, et al. Oxygen supply to the tissues during limited normovolemic hemodilution. Res Exp Med 1973;159:152.
-
Albert SN. Blood volume. Springfield, IL: Charles C Thomas, 1963:26.
-
Miller D. Normal values and examination of the blood: perinatal period, infancy, childhood and adolescence, In: Miller DR, Baechner RL, McMillan CW, et al., eds. Blood diseases of infancy and childhood. St. Louis: CV Mosby, 1984:21-22.
-
Shoemaker WC, Fluids and electrolytes in the acutely ill adult. In: Shoemaker WC, Ayres S, Grevik A, et. al., eds. Textbook of critical care, 2nd ed. Philadelphia: W.B. Saunders, 1989:1130-1150.
-
Hallowell P, Bland JHL, Chir B, et. al. Transfusion of fresh autologous blood in open-heart surgery. J Thorac Cardiovasc Surg 1972;64:941-948.
-
Ochsner JL, Mills NL, Leonard GL, et al. Fresh autologous blood transfusions with extracorporeal circulation. Ann Surg 1973;177:811-817.
-
Hardestry RL, Bayer WL, Bahnson HT. A technique for the use of autologous fresh blood during cardiac surgery. J Thorac Cardiovasc Surg 1968;5:683-688.
-
Wagstaffe JG, Clarke AD, Jackson PW. Reduction of blood loss by restoration of platelet levels using fresh autologous blood after cardiopulmonary bypass. Thorax 1972;27:410-414.
-
Kaplan JA, Cannarella C, Jones EL, et. al. Autologous blood transfusion during cardiac surgery: a re-evaluation of three methods. J Thorac Cardiovasc Surg 1977;74:4-10.
-
Silver H. Banked and fresh autologous blood in cardiopulmonary bypass surgery. Transfusion 1975;15:600-603.
-
Lilleaasen P, Froysaker T. Fresh autologous blood in open heart surgery. Influence on blood requirements, bleeding and platelets counts. Scand J Thor Cardiovasc Surg 1979;13:41–46.
-
Whitten CW, Allison PM, Latson TW, et al. Evaluation of laboratory coagulation and lytic parameters resulting from autologous whole blood transfusion during primary aortocoronary artery bypass grafting. J Clin Anesth 1996;8:229–235.
-
Kochamba GS, Pfeffer TA, Sintek CF, et al. Intraoperative autotransfusion reduces blood loss after cardiopulmonary bypass. Ann Thorac Surg 1996;61:900–903.
-
Helm RE, Klemperer JD, Rosengart TK, et al. Intraoperative autologous blood donation preserves red cell mass but does not decrease postoperative bleeding. Ann Thorac Surg 1996;62:1431–1441.
-
Khan R, Siddiqui A, Natrajan KM. Blood conservation and autotransfusion in cardiac surgery. J Card Surg 1993;8:25–31.
-
Lee J, Ikeda S, Johnston MF. Efficacy of intraoperative blood salvage during coronary artery bypass grafting. Min Cardioangiol 1997;45:395–400.
-
Petry AF, Jost T, Sievers H, et al. Reduction of homologous blood requirements by blood-pooling at the onset of cardiopulmonary bypass. J Cardiothorac Surg 1994;5:1210–1214.
-
Iyer VS, Russell WJ. Fresh autologous blood transfusion and platelet counts after cardiopulmonary bypass surgery. Anaesth Intens Care 1982;10:348–352.
-
Dale J, Lilleaasen P, Erikssen J. Hemostasis after open-heart surgery with extreme or moderate hemodilution. Eur Surg Res 1987;19:339–347.
-
Zubiate P, Kay JH, Mendez AM, et al. Coronary artery surgery: a new technique with use of little blood, if any. J Thorac Cardiovasc Surg 1974;68:263–267
|
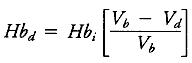
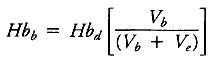
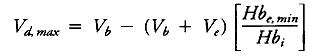

 В качестве альтернативы, кровь можно забирать в самом начале ИК через Y-коннектор установленный в венозную магистраль контура АИК (рис. слева).
В качестве альтернативы, кровь можно забирать в самом начале ИК через Y-коннектор установленный в венозную магистраль контура АИК (рис. слева).